激素受体阳性乳腺癌的免疫预防和免疫治疗控制
摘要
激素受体(HR)+乳腺癌(BC)导致大多数与BC相关的死亡,需要改进治疗方法。尽管有期望,但HR + BC 患者的免疫检查点阻滞剂(ICB)的活性较差,部分反映出缺乏能在免疫能力强的宿主中概述疾病进展的临床前模型。我们证明,由醋酸甲羟孕酮(M)和7,12-二甲基苯并[a]蒽(D)驱动的乳腺肿瘤概括了人类管腔B HR + HER2的几个关键特征-BC,包括有限的免疫浸润和对ICB的敏感性差。M / D驱动的肿瘤发生可通过免疫缺陷来加速,这表明M / D驱动的肿瘤正在接受免疫监视。包括烟酰胺(NAM)在内的安全营养措施可通过重新激活免疫监视来有效延迟M / D驱动的肿瘤发生。NAM还介导了针对已建立的M / D驱动和可移植BC的免疫治疗作用,这在很大程度上反映了恶性细胞I型干扰素分泌的增加以及免疫效应细胞的直接刺激。我们的发现确定NAM是预防和治疗HR + BC 的潜在策略。
介绍
激素受体(HR)+乳腺癌(BC)在美国和欧洲引起大多数与BC相关的死亡1。大多数新诊断为HR + BC的患者均通过初次手术进行治疗,然后进行辅助内分泌治疗±放射治疗。尽管基因表达谱可用于预测以蒽环类,环磷酰胺和紫杉类为基础的辅助化疗的获益2,但风险评估仍然不准确,治疗效果也各不相同,导致许多妇女受益于少数。认识到化疗对个人的益处是有限的,并且当前的疗法与相当大的副作用有关3 已经将BC研究转向包括免疫疗法在内的新方法。
免疫检查点阻断剂(国际商品机构)已经在多种肿瘤的管理已经成功实施4,5。越来越多的证据表明,免疫系统在控制乳癌的发生和肿瘤进展中也起着重要作用6。因此,最近有人建议靶向程序性细胞死亡1(PDCD1;最知名的PD-1)或CD274(主要PD-1配体,最知名的PD-L1)的ICB构成三阴性BC的良好治疗选择( TNBC)患者7。但是,HR + BC患者使用ICB的临床经验令人失望8。至少部分地,这反映了缺乏足够的临床前模型来概括具有免疫学能力的宿主中HR + BC 的发生率,自然进展和对治疗的反应。确实,人类异种移植本质上不足以研究小鼠的靶向肿瘤的免疫力,并且小鼠HR + BC细胞系在被其原始宿主免疫编辑后被植入(因此已经逃避了免疫识别)9。同样,转基因BC模型通常带有很少的非同义突变,因此对适应性免疫系统9基本上是不可见的。
为了规避这些问题,我们集中研究了缓慢释放的醋酸甲羟孕酮(MPA,M)颗粒与口服致癌物7,12-二甲基苯并[a]蒽(DMBA,D)10共同驱动的小鼠内源性BC 。MPA是一种多用途的合成孕激素,在绝经后妇女中用作激素替代疗法的一部分时,与BC的发病率增加有关11。DMBA是在香烟烟雾,工业污染和烤肉中发现的多环芳烃(PAH),暴露于这些危险因素与BC发病率增加相关12。
在这里,我们报告了深入的生物学,免疫学和功能研究的结果,这些结果表明,M / D驱动的乳腺肿瘤概括了人类管腔B(高度增殖的HR + HER2 --)BC的几种生物学和免疫学特征,因此构成了一种特权。研究具有转化潜力的治疗策略的平台。利用此模型,我们证明了烟酰胺(NAM)—一种维生素B 3的变体目前作为非营养补充剂在柜台上出售,不仅延缓了内源性乳癌的发展,而且还对M / D驱动的肿瘤和其他可移植的管腔B BC小鼠模型产生了免疫治疗作用。NAM的抗癌活性克服了其他常见的BC危险因素(包括高脂饮食(HFD))的有害影响,并且依赖于恢复T细胞依赖性免疫监测,否则在肿瘤发生过程中将无法起作用。这些发现表明,补充NAM是预防和治疗HR +BC 的潜在策略。
结果
M / D驱动的肿瘤概括了人类HR + BC的关键特征
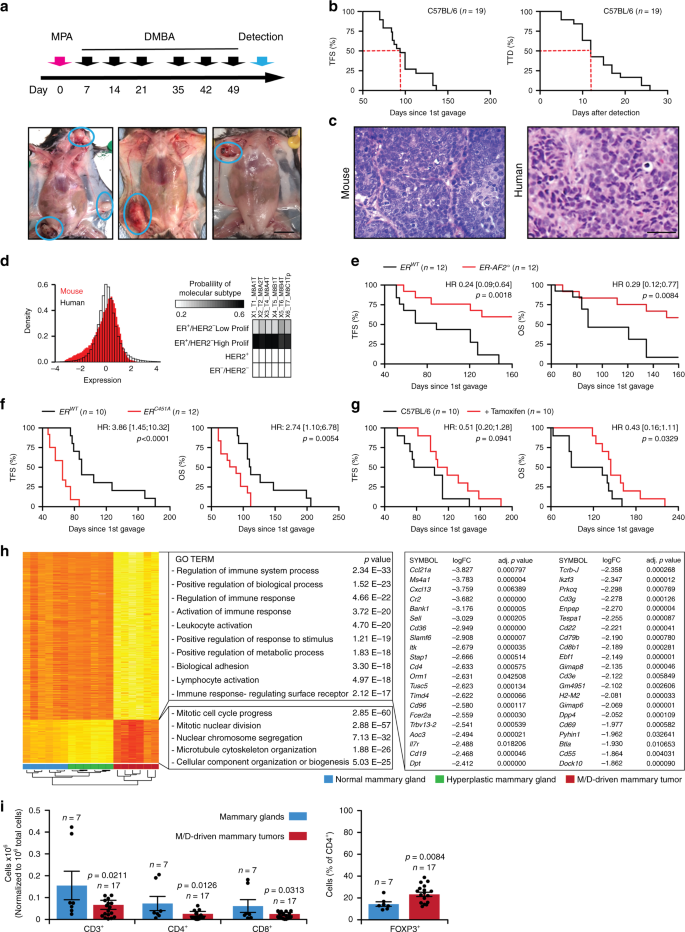
当6-9周大的雌性C57BL / 6小鼠植入释放MPA的缓释药丸时(第0天),并接受了6次口服强饲法的环境污染物DMBA(分别按1、2、3、5、6和植入MPA沉淀7周后,他们发展出乳腺肿瘤,潜伏期高度变化(约50-150天),在90-110天左右发生了50%的肿瘤(图 1a,b)。对于BALB / c雌性小鼠也记录了类似的发现(补充图 1a)。M / D驱动的乳腺肿瘤发生在腹股沟腹腔和宫颈胸腔位置的发病率略高(补充图1b),最初是单个病变,后来是多灶性疾病(至少在少数 情况下,补充图 1c)),如果不进行治疗,则进展迅速(图 1b)。
WT C57BL / 6小鼠中建立的用于诱发M / D驱动的肿瘤的致癌挑战的时间表以及M / D驱动的肿瘤的代表性图像。比例尺= 1厘米。b接受M / D驱动的肿瘤发生的WT C57BL / 6小鼠的无肿瘤生存期(TFS)和死亡时间(TTD)。报告了小鼠数量。c与人类HR +乳腺癌相比,M / D驱动的肿瘤的典型组织学。比例尺= 50 µm。d探针集分布,从TCGA公共数据库中比较了C57BL / 6小鼠中建立的6种M / D驱动的乳腺肿瘤与人类乳腺癌的转录组谱。报告了每种小鼠肿瘤的分子亚型的可能性。Ë,˚FWT C57BL / 6小鼠和带有ER突变的WT C57BL / 6小鼠的TFS和总体存活率(OS),这些突变导致受到M / D驱动的致癌作用的核排斥(e)或核积累(f)。报告了小鼠数量,危险比(HR)和p值(双面对数秩)。克 TFS和WT的OS C57BL进行M / d驱动的肿瘤发生在控制条件或沿与所述饮用水施用他莫昔芬/ 6小鼠。报告了小鼠数目,HR和p值(双面对数秩)。^ h。在WT C57BL / 6小鼠中建立的M / D驱动的肿瘤的转录组谱的无监督分层聚类(n = 6),暴露于M / D但未发育成肿瘤的乳腺(n = 6)和M / D初生乳腺(n = 6)。报告了基因本体分析,倍数变化(FC)和调整后的两侧p值。红色,上调。黄色,下调。我相对CD3的量+,CD8 +,CD4 +和CD25 + FOXP3 +细胞浸润M / d-驱动的肿瘤在C57BL / 6小鼠同系VS M / d-幼稚乳腺。结果是平均值±SEM加各个数据点。报告了小鼠数量和p值(未配对的两侧学生t,与M / D天真乳腺相比)。
由M / D驱动的肿瘤通常表现为:(1)相对单调的细胞群,界限分明,以松散的方式浸润周围的软组织和脂肪组织,(2)非典型上皮细胞的脐带和结节,带有一些导管或腺体(3)一定程度的血管和淋巴渗透(图 1c)。因此,M / D驱动的肿瘤在组织学上类似于人HR + BC。基于人类BC作为参考癌症基因组图谱(TCGA)数据库转录的研究显示,M / d-驱动的肿瘤显示惊人的相似,以高度增殖HR + HER2 - (管腔B)人BC(图 1D和补充图。 1D)。免疫荧光显微镜检查证实,未经治疗的M / D驱动的肿瘤表达雌激素受体1(ESR1,最著名的ER),但不表达波形蛋白(VIM,基底BC的标志物)(补充图 1e)。因此,M / D驱动的肿瘤在携带Esr1缺失的小鼠中出现动力学延迟,从而导致转录活性(ER-AF2 0)13缺失(图 1e),而在表达ER突变相关的小鼠中肿瘤发生和肿瘤进展加快核蓄积增加(ER C451A)14(图 1f)。ER拮抗剂他莫昔芬至少在该过程的早期阶段延迟了M / D驱动的肿瘤发生和与癌症相关的死亡(图 1g)。比较正常小鼠乳腺的转录组,暴露于M / D但未发育的肿瘤的增生性腺以及M / D驱动的肿瘤揭示了与恶性转化有关的重大变化,包括增殖相关基因的上调和下调与免疫功能相关的转录本的数量(图 1h)。特别是与生发中心(Btla,Cd4,Cd19,Cd22,Dock10,H2-M2)和第三类淋巴器官(Ccl21a,Ccl21b,Cd3d,Cd3e,Cd3g,Cxcl13,Dpp4,Il7r,Sell,Tcrb)在肿瘤发生过程中显着下调(图 1h)。一致地,与正常乳腺相比,已建立的M / D驱动的肿瘤表现出有限的CD3 + CD8 +细胞毒性T淋巴细胞(CTL)和CD3 + CD4 + T细胞浸润(图 1i),并且其CD4 +区室富集在免疫抑制的FOXP3 +调节性T(T REG)细胞中(图 1i)。因此,在具有免疫能力的小鼠中建立的M / D驱动的肿瘤概括了人类管腔B BC的关键方面,而后者也很少被免疫细胞6浸润。
M / D驱动的肿瘤受到NK细胞的免疫监视
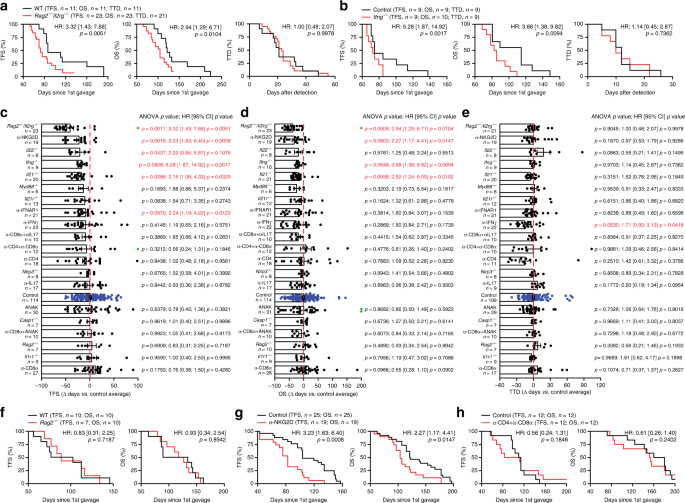
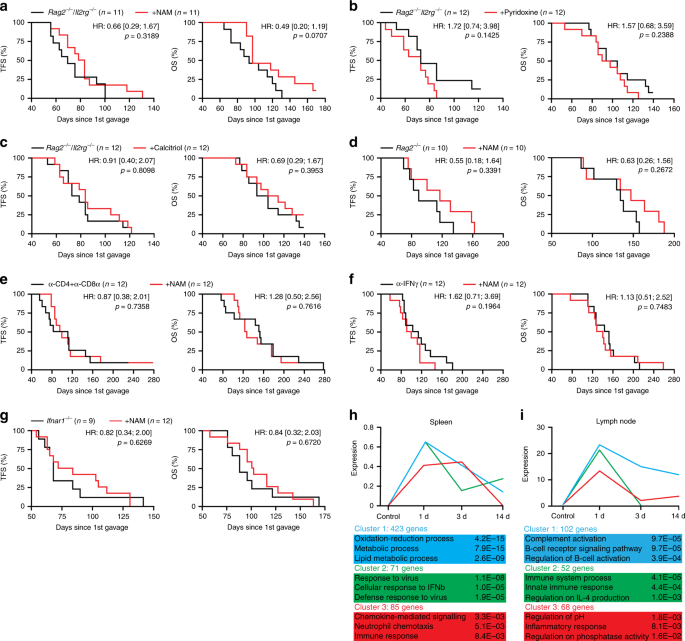
根据转录组和细胞荧光数据(图 1h,i),我们推测M / D驱动的肿瘤会通过逃避免疫监测而进化。实际上,在Rag2 - / - Il2rg - / -小鼠(缺少T细胞,B细胞和NK细胞)中,M / D驱动的致癌作用得以加速,总生存期(OS)缩短了(图 2a),以及在缺乏干扰素γ(Ifng,编码淋巴免疫监视的主要效应子)的小鼠中(图 2b)。表征免疫成分对HR +出现的影响肿瘤,我们进行了一项大规模实验,比较了未经治疗(或假治疗)的野生型(WT)BALB / c或C57BL / 6在M / D驱动的肿瘤发生后的无肿瘤生存期(TFS)和OS小鼠和:(1)小鼠带有范围在先天不同遗传缺陷和适应性免疫功能(基因型:CASP1 - / - ,IL-21 - / - ,IL-22 - / - ,IL21R - / - ,IL1R1 - / - ,MYD88 - /-,Nlrp3 -/-,Rag2 -/-); (2)用中和特定细胞因子(即IFNG,IL17)或细胞因子受体(即IL1R,IFNAR1)的药剂治疗的WT小鼠;或(3)耗尽了CD4 +和CD8 +细胞或NK细胞的WT小鼠。该实验证实了M / D驱动的致癌作用在产生IFNG的细胞的控制下,并揭示了在这种情况下,IIl21或Il22的缺失,IFNAR1的阻滞以及NKG2D +细胞的耗竭也促进了肿瘤的发生(图。 2c)。这些效应在Ifng -/-和 Il21 -/-基因型以及NKG2D +细胞耗竭的OS水平上也很明显(图。 2d)。从发现到死亡的时间(到死亡的时间,TTD)计算的疾病进展仅通过IFNG中和抗体来加速(图 2e)。重要的是,尽管严重的免疫缺陷会影响T淋巴细胞,B细胞和NK细胞(Rag2 - / - Il2rg - / -基因型),而Tg和OS在Rag2 - / -小鼠(缺乏T淋巴细胞)中会导致M / D驱动的肿瘤发生B细胞和B细胞,但具有完整的NK细胞室)9与WT小鼠的TFS和OS没有区别(图 2f)。此外,NKG2D +的耗竭对TFS和OS产生了负面影响细胞(包括NK细胞和T细胞),但不通过CD4 +和CD8 +淋巴细胞的共消耗而消失(图 2g,h)。总而言之,这些发现确立了免疫逃避对于HR + BC 出现和发展的重要性,并着重于NK细胞介导的免疫监视背景下的干扰素信号传导。为了进一步支持这一观点,他莫昔芬在Rag2 - / - Il2rg - / -小鼠中丧失了部分抑癌作用(补充图 1f)。
a,b WT C57BL / 6小鼠(a,b)和Rag2 - / - Il2rg - / -小鼠(a)的无肿瘤生存期(TFS),总生存期(OS)和死亡时间(TTD )或Ifng - / -小鼠(b)经历了M / D驱动的致癌作用。报告了小鼠数量,危险比(HR)和p值(双面对数秩)。c– e。TFS(c),OS(d)和TTD(e通过指定的基因型或免疫调节干预作用于小鼠的M / D驱动的肿瘤发生。结果是平均值±SEM加各个数据点。报告了小鼠数量,HR和p值(相对于单个对照实验计算的双面对数秩和单向ANOVA加Fisher LSD)。绿点表示在实验结束时没有疾病(c)和存活(d)的小鼠。f - h WT C57BL / 6(f - h)小鼠和Rag2 - / - BALB / c小鼠(f),C57BL / 6小鼠接受消耗NKG2D抗体的TFS和OS (g)或接受CD4和CD8耗竭抗体的C57BL / 6小鼠(h)。报告了小鼠数目,HR和p值(双面对数秩)。
M / D驱动的肿瘤被T细胞免疫编辑不良
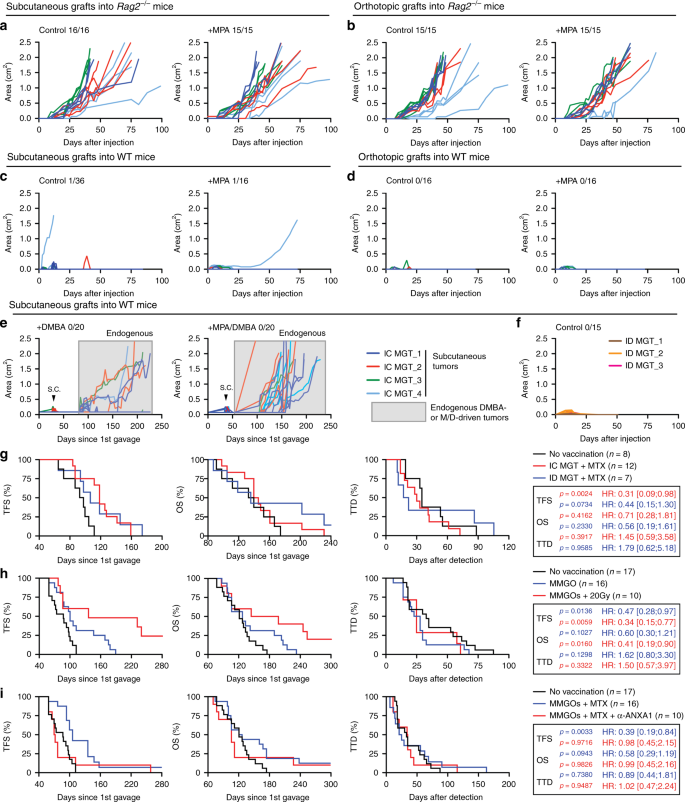
为了进一步探索HR + BC中的免疫监视,我们从免疫能力强的小鼠中发展的M / D驱动肿瘤中建立了细胞系。当皮下注射(皮下注射)或注射到免疫缺陷的Rag2 -/-小鼠的乳腺脂肪垫中时,这些细胞系迅速产生具有侵袭性,对MPA不敏感的增殖的癌症(图 3a,b)。与之形成鲜明对比的是,这些细胞系仅在sc注射入具有免疫能力的同基因C57BL / 6宿主中时偶尔散发(52次尝试中的2次)产生进行性损伤(图3c),并且在原位植入后始终无法建立进展的肿瘤(图 3b)。 3D),无论小鼠是否接受了MPA。通常,会形成小的肿瘤(通常小于50 mm 2的表面),但随着时间的推移会自发消退(图 3a–d)。单独或与MPA组合使用DMBA,均无法促进经皮下注射的M / D驱动的癌细胞的生长。在同基因免疫能力强的受者中,尽管它会引起内源性肿瘤的发展(在单独的DMBA的5/20小鼠和在DMBA + MPA的20/20小鼠中)(图 3e),这暗示DMBA不会在该模型中引起严重的免疫缺陷。作为一个额外的对照,当由Rag2 -/-小鼠进化出的M / D驱动的肿瘤建立的乳腺癌细胞系移植到WT小鼠中时始终未能发展出肿瘤(图。 3f)。
a – d由在Rag2- /皮下植入(a,c)或原位(b,d)的免疫能力(IC)小鼠中发育成的M / D驱动的肿瘤(以下称为乳腺肿瘤,MGT)建立的细胞系生长。-(a,b)或IC C57BL / 6小鼠(c,d)可选地带有MPA释放小球。报告了个体曲线和肿瘤发生率。Ë皮下植入ICG57BL / 6小鼠接受单独DMBA或在释放MPA的情况下MGT的生长。报告了所有肿瘤和皮下肿瘤发生率的单独曲线。空心曲线表示仅由DMBA或MPA加DMBA引起的内源性肿瘤。f由皮下植入IC C57BL / 6小鼠的免疫缺陷(ID)Rag2 -/-小鼠中发展的M / D驱动肿瘤建立的MGT的生长。报告了个体曲线和整体肿瘤发生率。G在对照条件下或接种由M / D建立的细胞系进行M / D驱动致癌作用的WT C57BL / 6小鼠的无肿瘤生存期(TFS),总生存期(OS)和死亡时间(TTD) IC或ID小鼠体内发生的非驱动性肿瘤,并在体外用米托蒽醌(MTX)治疗。报告了小鼠数量,危险比(HR)和p值(与未接种疫苗的小鼠相比,对数为双面)。h WT C57BL / 6小鼠的TFS,OS和TTD在对照条件下或通过接种小鼠乳腺类器官(MMGO)进行M / D驱动的致癌作用后可选地通过一次暴露于放射疗法(RT)体外杀死剂量为20 Gy。小鼠数,心率和p报告了数值(与未接种疫苗的小鼠相比,双侧对数秩)。请注意,这些结果的一部分(控制条件)也在(i)中描述。我 TFS,OS,和WT的TTD C57BL / 6小鼠进行M / d驱动的肿瘤发生在控制条件下或在接种MMGOs在体外中和ANXA1的可选的上下文杀害米托蒽醌(MTX)施用。报告了小鼠数量,HR和p值(与未接种疫苗的小鼠相比,两侧对数秩)。请注意,这些结果的一部分(控制条件)也在(h)中描述。
预防接种会延迟M / D驱动的癌变
接下来,我们调查了用从M / D驱动的癌症建立的细胞系接种免疫活性小鼠是否会对M / D驱动的肿瘤发生产生预防作用。为了这个目的,从M / d-驱动的肿瘤在演进建立的细胞系的Rag2 - / -或野生型小鼠在体外与免疫原性细胞死亡诱导剂米托蒽醌(MTX)杀死15,16,并注射到野生型小鼠1的脂肪垫从头开始M / D驱动的致癌作用的前一周,第4周和第2天。不管细胞来源的宿主的免疫状态如何(Rag2 -/- vs WT),这种治疗都推迟了M / D驱动的肿瘤的出现(图 3g)。)。重要的是,从正常乳腺上皮任选地与MTX或放射治疗(免疫原性细胞死亡的诱导物的另一个)处理类器官的注射15,16 -had类似的能力,以延迟M /驱动d肿瘤发生在C57BL / 6小鼠(图 3小时,我)。在该设定中,参与细胞死亡的感知作为免疫原性膜联蛋白A1(ANXA1)-a危险信号的中和15,16 -abolished接种作用(图 3I)。因此,通过包括疫苗接种在内的免疫干预,至少可以在一定程度上增强M / D驱动的癌变的免疫监视。
安全的营养措施延迟了M / D驱动的癌变
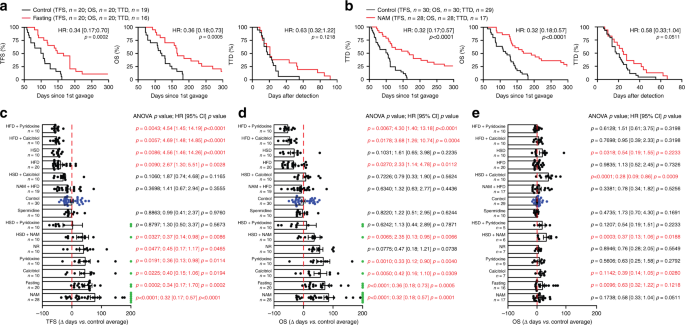
多种流行病学研究表明,营养状况对不列颠哥伦比亚省的发病率有重要影响17,现在已经确定饮食干预可以介导治疗相关的免疫刺激作用18。因此,我们分析了营养干预对WT C57BL / 6小鼠中M / D驱动的癌变的影响。我们发现,每两周24小时的空腹周期会延迟M / D驱动的肿瘤发生,减缓疾病进程并因此延长OS(图 4a),尽管与不受限制地获得标准体重相比,它们并不会导致体重稳定下降食物(补充图 1g)。与此类似,NAM的饮食补充(图 4b)和烟酰胺核糖核苷(NR),这是维生素B 3的两个变体,吡ido醇(维生素B 6)和骨化三醇(维生素D 3)均易于改善遭受M / D驱动致癌作用的WT C57BL / 6中的TFS和OS。 (图 4c–e)。相反,在饮食中添加亚精胺(具有显着生命延长作用的多胺)19不会影响M / D驱动的肿瘤发生(图 4c-e)。在所有测试的维生素中,饮用水中提供的NAM(比通过NR补充食物具有更高的活性)是在相当一部分(〜25%)的小鼠中唯一完全阻断(> 300天)肿瘤发生的方法,并且强烈延缓疾病进展(图 4a–e)。值得注意的是,日粮向C57BL / 6小鼠补充NAM可使循环NAM水平达到〜16.3 µg mL -1 µM(补充图 1h),而在接受2 g维生素的健康志愿者中,NAM的浓度约为2.3 µg mL -1。烟酸(NAM的前体)每os 20。NAM的有益效果也可以在immunoevasive,管状B BC由多瘤病毒中间T驱动的转基因模型记载(PyMT)抗原下的MMTV启动子的控制下表达21,22(补充图 1I)。
a,b在对照条件下(a,b)或在上下文中经历M / D驱动致癌作用的C57BL / 6小鼠的无肿瘤生存期(TFS),总生存期(OS)和死亡时间(TTD)每周24小时禁食(a)或NAM补充饮用水(b)。报告了小鼠数量,危险比(HR)和p值(双面对数秩)。c – e TFS(c),OS(d)和TTD(e)通过指定的营养干预措施对C57BL / 6小鼠的M / D驱动的肿瘤发生施加了作用。结果是平均值±SEM加各个数据点。报告了小鼠数量,HR和p值(相对于单个对照实验计算的双面对数秩和单向ANOVA加Fisher LSD)。绿点表示在实验结束时没有疾病(c)和存活(d)的小鼠。HFD高脂饮食,HSD高蔗糖饮食,NR烟酰胺核糖苷。
高蔗糖饮食(HSD)加速了M / D驱动的致癌作用,同时补充NAM完全消除了这种作用,这继续使TFS和OS超出了正常小鼠喂养的对照小鼠的水平(尽管只有一只小鼠仍处于癌症状态) -无)(图 4c–e)。当在吡ido醇或骨化三醇补充的情况下提供HSD时,观察到对TFS,OS或TTD的不太明显的有益作用(图 4c-e)。富含脂肪的饮食方案(高脂饮食,HFD)加速了M / D驱动的致癌作用并缩短了OS,但对TTD没有影响(图 4c-e)。NAM完全拮抗了HFD的这种有害作用,而骨化三醇或吡ido醇则没有(图 4c–e))。在这种情况下,NAM还逆转了由HFD引起的体重增加(补充图 1f)。总之,M / D驱动的肿瘤发生对饮食变化敏感,对包括HSD和HFD在内的人类BC具有确定的有害作用,而NAM在所有这些情况下均具有强大的抗癌作用。
NAM介导依赖T细胞的化学预防作用
我们观察到,在Rag2 - / - Il2rg - / -小鼠中,NAM,吡ido醇和骨化三醇的抗癌作用始终不变(图 5a–c)。此外,NAM -依赖性oncoprevention在被废除的Rag2 - / -小鼠中,在经受CD4的抗体-介导的共消耗小鼠+和CD8 + T细胞中,在接收到IFNG中和抗体的小鼠,以及IFNAR1 - / -小鼠(图 5d–g)。这些数据进一步支持了干扰素信号传导是HR + BC 免疫监测的关键的观点。此外,他们证明了在这种模型中具有肿瘤预防作用的营养干预措施(例如补充NAM)可增强T细胞依赖性免疫监视。
a – c Rag2 - / - Il2rg - / -小鼠在控制条件下(a – c)或与NAM(a)一起接受M / D驱动的肿瘤发生的无肿瘤生存期(TFS)和总体生存期(OS ),补充吡ido醇(b)或骨化三醇(c)。报告了小鼠数量,危险比(HR)和p值(双面对数秩)。d – g Rag2 - / -小鼠的TFS和OS (d),接受CD4和CD8α耗尽抗体的C57BL / 6小鼠(e),接受IFNG中和抗体的C57BL / 6小鼠(f)和接受M / D驱动致癌作用的Ifnar1 - / -小鼠(g)。控制条件或与NAM一起补充饮用水。报告了小鼠数目,HR和p值(双面对数秩)。h,i基因集富集了接受NAM补充饮用水1天,3天或14天的,初生肿瘤的C57BL / 6小鼠的脾脏(h)和淋巴结(i)。调整后的双面p 报告富集值。
已建议NAM触发自噬,这是一种涉及一次性或潜在危险胞质实体的溶酶体降解的细胞保护途径23。但是,我们未能检测到自噬的一致生化迹象,例如微管相关蛋白1轻链3 beta(MAP1LC3B,最知名的LC3)的脂质化和螯合体1(SQSTM1,最知名的p62)在M /尽管使用了NAM,D驱动的肿瘤仍在发展,并且在多个健康组织中也发展(补充图 2a)。此外,NAM的抗癌作用在Becn1 + / -小鼠(表现出部分自噬缺陷并增加了对乳癌发生的敏感性)中得以保留24,图 25(补充图 2b)。类似地,M / d驱动的肿瘤发生仍有NAM介导的中经受的条件敲除小鼠oncoprevention敏感 Atg5的(自噬机制的关键成分) 26在角蛋白5(KRT5)表达细胞(包括乳腺上皮细胞) 27(补充图 2c),表明该作用不需要在恶性细胞中诱导自噬。为了进一步探索NAM的免疫刺激活性,将无肿瘤的C57BL / 6小鼠用NAM处理1、3或14天,然后进行脾细胞和淋巴结细胞的RNAseq分析。在这种情况下,我们检测到了与免疫功能有关的基因组的早期上调,特别是I型干扰素信号传导和趋化性(图 5h,i)。但是,我们无法检测到CD8 + T细胞,CD4 + T细胞,CD4 +FOXP3 +调节性T(T REG),未接受过肿瘤治疗的C57BL / 6小鼠的脾脏和淋巴结的NK细胞,NKT细胞和B细胞区室在饮用水中接受NAM达14天(补充图 2d,e),这表明NAM的能力延迟M / D驱动的致癌作用涉及与免疫效应剂的系统性扩张/收缩无关的免疫途径。总而言之,NAM似乎通过依赖于淋巴样细胞(T细胞和NK细胞)以及干扰素信号传导的自噬独立免疫机制介导了抗癌作用。
NAM介导针对BC的免疫治疗活性
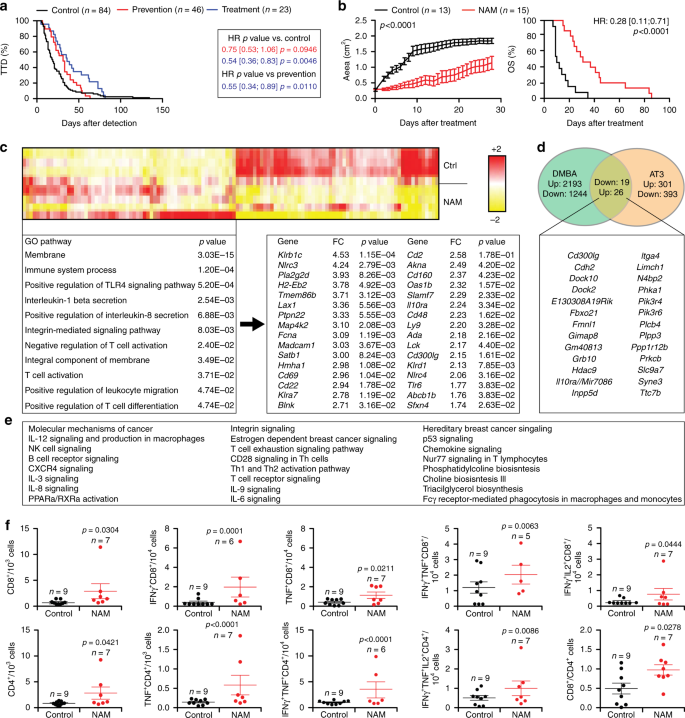
连续NAM补充会延迟暴露于M / D驱动的癌变小鼠的致癌作用,从而延长OS(图 4b-e)。当在肿瘤检测时(而不是之前)开始饮食中添加NAM时,NAM介导的治疗效果比从肿瘤发生中连续提供NAM所观察到的效果更明显(图6a,b),并且与NAM 的丧失无关。管腔B(ER + VIM - )表型(补充图 3a中)。NAM介导的治疗活性,可以在管状B BC(AT3和TSA细胞)的移植模型28,29以及在具有免疫能力的同系宿主中建立的可移植性纤维肉瘤肉瘤模型(MCA205细胞)(补充图 3b-d)。这种作用并不依赖于自噬激活,正如经受了shRNA依赖的ATG7(自噬机制的核心成分)30的 AT3细胞以及Atg7 - / - TSA细胞所证实的(补充图 3e, f)。
一个进行M / C57BL / 6小鼠的时间-死亡(TTD)d驱动的致癌作用在控制条件下或在NAM补充饮用水的上下文中,无论是从MPA粒料注入(预防)或肿瘤检测(治疗)。报告了小鼠数量,危险比(HR)和p值(双面对数秩)。b携带已建立的M / D驱动的肿瘤的C57BL / 6小鼠的肿瘤生长和总体生存(OS),这些肿瘤维持在对照条件下或接受NAM补充饮用水。肿瘤生长结果是平均值±SEM。报告了小鼠数目,HR和p值(双向ANOVA校正了肿瘤生长的行(时间)和列(治疗)因子,以及OS的双面对数秩)。C在未经治疗(n = 4)与NAM治疗(n = 4)M / D驱动的肿瘤中差异表达的基因的非监督分层聚类。报告了最高上调的基因,倍数变化(FC)和调整后的两侧p值。指出了基因本体分析和调整的富集的两侧p值。d比较在M / D驱动的肿瘤中与在C57BL / 6小鼠中建立的AT3肿瘤中,NAM处理诱导的私人和共有转录变化。提供了两个模型中由NAM上调的基因列表。另见补充图 3g。Ë两种M / D驱动的肿瘤在C57BL / 6小鼠中建立的AT3肿瘤中NAM上调的基因的创造力途径分析。f C57BL / 6小鼠中建立的AT3肿瘤的免疫浸润,将其维持在对照条件下或接受NAM补充饮用水(从肿瘤检测开始)持续10天。结果是平均值±SEM加各个数据点。报告了小鼠数量和p值(单向方差分析加上Fisher LSD)。
为了机械地探索NAM的治疗效果,我们比较了未治疗和NAM治疗的M / D驱动肿瘤的转录组谱,揭示了免疫调节的迹象(图 6c)。特别是,NAM的施用恢复了在M / D驱动的肿瘤发生过程中丢失的一些生理转录特征(图 1h),例如与生发中心相关的基因表达(Cd22,Dock10,Gimap8)(图1h)。图 6c),以及(在较小程度上)淋巴样细胞活化(Cd48,倍数变化= 2.23,p = 1.62E-02;Cd160,倍数变化= 2.37,p = 4.23E-02;Cd244,倍数变化= 2.84,p = 5.07E-03)。对未经治疗和经 NAM治疗的AT3肿瘤的类似研究确定了与T细胞分化以及I型和III型干扰素信号传导相关的转录模式(补充图 3g)。在响应NAM的M / D驱动和AT3乳腺肿瘤中,只有23个基因被一致上调(图 6d和补充图 3g)。机敏性途径分析表明,这些基因中的大多数积极调节免疫过程,包括识别抗原决定簇(TCR信号,BCR信号,共受体信号)以及NK细胞,白介素和趋化因子信号(图 6e)。)。但是,当我们比较未治疗的M / D驱动肿瘤在0.7-1 cm 2表面积与NAM治疗的肿瘤(相似大小)的免疫学浸润时,我们未能发现CD8丰度的一致变化+,CD4 + T细胞和T REG细胞,NK和NKT细胞以及B细胞(补充图 4a)。而且,我们未能检测到未治疗的和未接受NAM治疗的肿瘤的CD8 +,CD4 + T细胞和T REG细胞在增殖(Ki67阳性)方面有显着差异(补充图4a)。 )。我们在患有M / D驱动肿瘤的C57BL / 6小鼠的脾脏和淋巴结中进行了类似的观察,这归因于模型的相当多的异质性(补充图 4b,c)。相反,与未治疗的肿瘤相比,用NAM治疗的AT3肿瘤表现出增加的CD8 +和CD4 + T细胞水平,以及更高的CD8 + / CD4 + T细胞比率(图 6f)。此外,与之相比,NAM治疗的AT3肿瘤含有更多量的CD8 +细胞(共)表达效应分子IFNG和肿瘤坏死因子(TNF),以及共表达IFNG加上T细胞促分裂原白介素2(IL2)。他们未经处理的对应物(图。 6f)。类似地,在AT3模型中,NAM治疗与表达单独的TNF,TNF和IFNG以及TNF,IFNG和IL2 的CD4 + T细胞的肿瘤浸润增加有关(图 6f)。
NAM介导直接和间接的免疫刺激作用
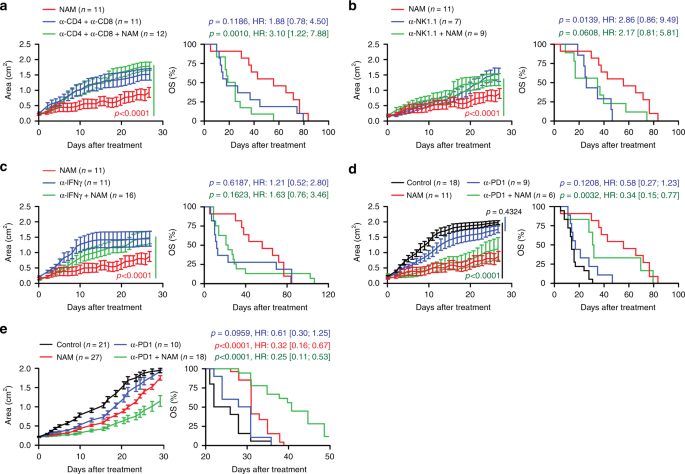
为了规避M / D驱动模型的异质性,并获得对构成NAM治疗活性基础的免疫电路的可靠机制的了解,我们进行了耗竭/中和实验。这种方法证实NAM的治疗活性取决于免疫系统,如涉及CD4 +和CD8 + T细胞,表达NK1.1的淋巴细胞亚群(NK细胞,NKT细胞和活化的亚CD8 + T细胞)31或IFNG中和(图 7a–c)。同样,CD4 +和CD8 +的共同消耗消除了NAM抑制AT3肿瘤生长的能力。T细胞以及IFNAR1,IFNG和IL17的中和作用(补充图 4d–g)。
a – c携带已建立的M / D驱动肿瘤的C57BL / 6小鼠的肿瘤生长和总体生存(OS),这些肿瘤维持在对照条件(a – c)或仅用饮用水补充NAM(a – c) ,或在CD4 +和CD8 + T细胞共耗竭(a),NK细胞耗竭(b)或IFNG中和(c)的情况下。肿瘤生长结果是平均值±SEM。小鼠数,危险比(HR)和p值(针对肿瘤生长的行(时间)和列(治疗)因子对双向ANOVA进行校正,对OS进行双向对数排序)。请注意,(a – c)中用NAM治疗的肿瘤(红色曲线)来自同一实验,也描述于(d)中。d,e携带建立的M / D驱动的(d)或TSA(e)肿瘤的C57BL / 6(d)或BALB / c(e)小鼠的肿瘤生长和OS ,其维持在对照条件下或接受NAM补充。饮用水或全身性PD-1阻塞,单独或组合使用。肿瘤生长结果是平均值±SEM。小鼠数,危险比(HR)和p值(针对肿瘤生长的行(时间)和列(治疗)因子对双向ANOVA进行校正,对OS进行双向对数排序)。请注意,(d)中用NAM治疗的肿瘤(红色曲线)来自(a – c)中描述的相同实验。
M / D驱动的癌在对PD-1受体阻滞剂的敏感性有限的情况下也类似于人HR +BC 8(图 7d)。在这种情况下,NAM的治疗活性优于单独给药的PD-1阻滞剂,并且将PD-1阻滞剂添加到NAM治疗中未能改善后者的治疗活性(图 7d)。相反,在TSA模型中,NAM与PD-1阻滞协同作用(图 7e)。同样,在M / D驱动的模型和AT3模型中,NAM可以与基于MTX的化学疗法相结合,并且比单独使用NAM或MTX可以延长小鼠的生存期(补充图 3B和4H)。
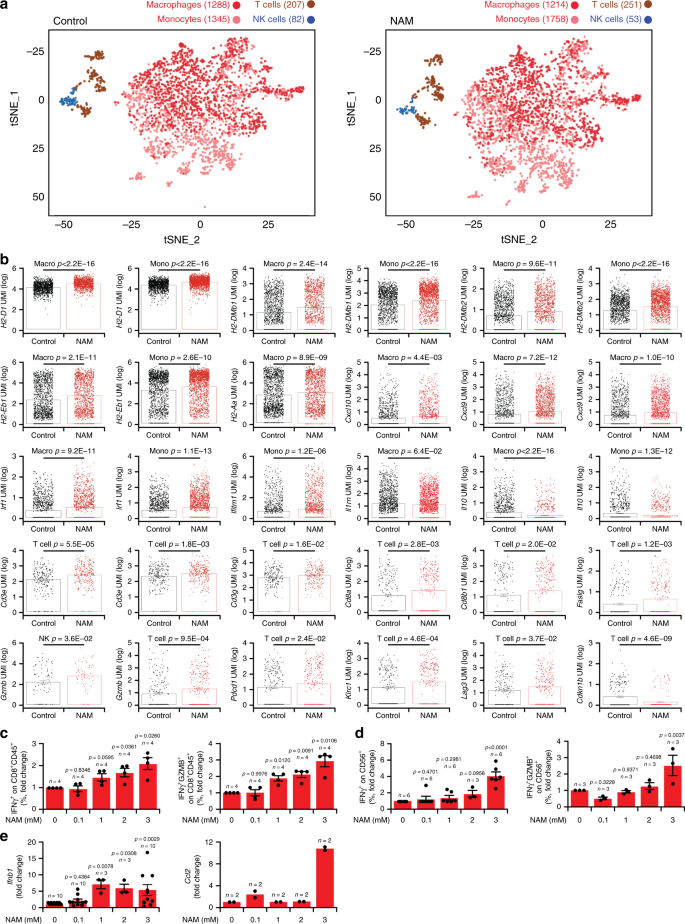
最后,我们对浸润未治疗和NAM治疗的TSA肿瘤的CD45 +白细胞进行了单细胞RNAseq(scRNAseq),揭示了NAM治疗的肿瘤的免疫浸润度有轻度的数值变化,包括T细胞和单核细胞(包括DCs)频率增加)与肿瘤相关巨噬细胞(TAMs)和NK细胞的丰度降低有关(图 8a)。更重要的是,NAM引发了所有这四个免疫细胞群的转录谱的显着变化(差异表达的基因:巨噬细胞中的1884,单核细胞中的1541,T细胞中的590和NK细胞中的283),包括支持先天性和适应性的多种改变免疫力(补充图 5a-d和补充数据1)。具体而言,单核细胞和TAM表达的水平升高了(1)多个MHC分子,包括H2-Aa,H2-DMb1,H2-DMb2,H2-D1和H2-Eb1;(2)T细胞募集细胞因子,例如CXC基序趋化因子配体9(CXCL9)和CXCL10,以及(3)响应I型IFN信号传导的蛋白,例如干扰素调节因子1(IRF1)和干扰素诱导的跨膜蛋白1(IFITM1) )(图 8b和补充数据 1)。相反,浸润NAM治疗的肿瘤的单核细胞和TAM表现出免疫抑制因子如IL10和白介素1受体拮抗剂(IL1RN)的较低表达(图 8b和补充数据 1)。)。在其他变化中,浸入 NAM处理的肿瘤的T细胞表现为(1)涉及抗原识别的基因表达增加,包括Cd3d,Cd3e,Cd3g,Cd8a和Cd8b1;(2)上调效应分子,包括颗粒酶B(GZMB)和Fas配体(FASLG);(3)表面活化标记物(例如PD-1),杀伤细胞凝集素样受体亚家族C,成员1(KLRC1,最知名的NKG2A)和淋巴细胞活化3(LAG3)的水平升高,以及(4)阴性水平降低细胞周期调节剂,例如细胞周期蛋白依赖性激酶抑制剂1B(CDKN1B)(图 8b和补充数据 1)。尽管其数目有限,但与未处理的肿瘤的NK细胞相比,浸润NAM治疗的肿瘤的NK细胞也表现出更高水平的GZMB(图 8b和补充数据 1),这表明(至少在某种程度上)功能性激活。与这些转录变化一致,基因本体论(补充图 6b)和标志(补充图 6b)分析显示,与NAM治疗和未治疗的TSA肿瘤的免疫浸润相比,与免疫激活相关的多个基因集丰富。整体(CD45 +细胞)及其特定成分(巨噬细胞,单核细胞,T细胞,NK细胞)。此外,免疫荧光显微镜和RT-PCR证实了NAM 在TSA和M的微环境中增加免疫效应细胞(CD8 + T细胞)和转录本(Gzmb,Ifng和Prf1,尽管后者显着)的丰度。/ D驱动的肿瘤(补充图 7a,b)。总而言之,这些发现进一步支持了NAM介导依赖免疫系统的治疗作用的观点。
未治疗和NAM治疗的TSA肿瘤的 tSNE图。报告了四个主要种群中每个种群的细胞数量。b从未治疗的和NAM治疗的TSA肿瘤分离的CD45 +细胞中涉及免疫调节的基因的差异表达。结果为平均值±SEM加各个数据点。在(a)中报告了针对每个基因独立分析的细胞数,并指出了p值(双面Wilcoxon试验)。另见补充数据 1。c,d在CD8 + T细胞中IFNG +和IFNG + GZMB +的百分比(c)和健康供体外周血单核细胞(PBMC)的CD56 + NK细胞(d)在指定浓度的NAM存在下进行非特异性激活过夜。结果是平均值±SEM加各个数据点。报告了生物学上独立样品的数量和p值(与未处理的细胞相比,单向ANOVA + Fisher LSD)。e在对照条件下培养或暴露于指定浓度的NAM 48小时的TSA细胞中,Ifnb1和Ccl2的相对表达水平。结果是平均值±SEM加各个数据点。生物学独立的样本数和p 报告了数值(单向方差分析加Fisher LSD,与未处理细胞相比)。
为了进一步了解这种可能性,我们将健康供体的外周血单个核细胞(PBMC)暴露于佛波醇12-肉豆蔻酸13-醋酸盐(PMA)加上离子霉素作为非特异性激活刺激物,单独或在存在NAM的情况下,后者有利于T细胞和NK细胞的积累,它们单独表达IFNG或共同表达IFNG和GZMB(图 8c,d)。我们排除了NAM可介导恶性细胞上健壮的细胞毒性作用的可能性,即使在高度超生理浓度(补充图 7C),而鉴定NAM的从驱动转录没有料到能力IFNB1轨迹,以及从所述中Ccl2基因座(图 8e),它编码单核细胞的有效趋化因子。总而言之,这些发现与scRNAseq和功效数据一致,表明NAM介导了直接和间接的免疫刺激作用,这些作用影响T细胞的活化。
讨论区
在这里,我们证明了M / D驱动的肿瘤概括了人类HR + BCs的关键免疫生物学特征,这些特征占BC 1的大部分。M / d-驱动的肿瘤经由ER依赖性致癌过程在免疫活性宿主的出现,并且因为它们逃避免疫监视,与建立乳腺肿瘤的与管状B最终进展(高增殖性HER2 - ER + VIM - )表型无法随着时间的推移或治疗后,转化为基础(ER − VIM +)。此外,在具有免疫能力的小鼠中发展的由M / D驱动的肿瘤类似于人腔B BC,因为它们表现出常见的PI3KCA突变32,免疫渗透差,对ICBs的敏感性有限8,并且可以通过营养干预措施来加速,这些干预措施在流行病学上与人类HR + BC的倾向性增加有关,例如HFD 17。该模型的警告之一与以下事实有关:尽管ER + BC是女性中BC最常见的形式,但只有一部分ER + BC与孕激素的使用有关11。此外,M / D驱动的模型以相当不同的方式发展,这需要使用大型实验组来支持统计能力,并显示出管腔B型,这是包括TSA和AT3细胞在内的其他小鼠BC模型所共有的28,29岁,以及表达MMTV-PyMT的小鼠22。就是说,异质性也是人类ER +BC的一个特征,据我们所知,没有其他文献能够证明HR + BC能够研究肿瘤发生,肿瘤进展以及对免疫完整宿主的治疗反应9。因此,M / D驱动的肿瘤是研究BC免疫监视,对(免疫)治疗的抵抗力以及对通过免疫机制进行的营养干预措施的敏感性研究的优先模型,因此脱颖而出。
有趣的是,M / D驱动的肿瘤发生似乎很大程度上受涉及干扰素信号传导和NK细胞功能的免疫网络控制。这是在与内源性驱动致癌的其他模式,如甲基胆蒽(MCA) -依赖性纤维肉瘤赔率33以及与由缺乏T细胞或它们的分子的效应物自发加速癌变许多情况34,潜在地构成HR + BCs的特殊性。在这种情况下,补充NAM饮用水不仅可以预防M / D驱动的肿瘤(作为预防性干预措施)的表现,而且可以在肿瘤检测开始时介导治疗效果。在这两种设置中,NAM的效果取决于CD8+ T淋巴细胞,但NK细胞少。这些发现提出了有趣的可能性,即小鼠的M / D驱动的癌变(可能是女性的HR +乳腺癌变)可能受到NK细胞的自然免疫监视35,并且可以利用NAM重新启用T细胞依赖性肿瘤预防和治疗方面的控制。因此,已建立的HR +肿瘤可能表现出功能异常的NK细胞区室,可能对最近开发的NKG2A 36特异性抗体的再激活敏感。在免疫能力强的动物中发展为MCA驱动的纤维肉瘤通常可移植到免疫能力强和免疫缺陷的宿主中,这进一步支持了这一观点33,这不适用于M / D驱动的肿瘤,无论其最初在宿主中的免疫能力如何,通常都会被具有免疫能力的动物排斥。这表明,即使在具有免疫能力的宿主中,正在发展的M / D驱动的肿瘤也很难通过T淋巴细胞进行编辑,因此通过积累抗原决定簇来发展,这些抗原决定簇可以阻止未植入肿瘤的具有免疫能力的小鼠移植。T细胞无法控制M / D驱动的致癌作用和编辑不断发展的M / D驱动的肿瘤的确切分子机制仍有待阐明。
在本研究过程中,我们发现NAM在控制各种B型腔BC小鼠模型(包括M / D驱动的肿瘤以及在有免疫能力的宿主中建立的TSA和AT3肿瘤)的控制方面特别有效药物和与临床批准的药物(例如蒽环类药物和PD-1阻滞剂)组合使用。这项研究中使用的NAM剂量(与饮用水一起使用,占0.5%w / w)无疑会导致血源性NAM的超生理水平(16.3 µg mL -1)。尽管据记录,健康的志愿者每os接受2 g烟酸(NAM的前体)的NAM 峰值浓度约为2.3 µg mL -1,但20尚不清楚是否可以在人类中安全地达到更高的稳态NAM水平。这就是说,NAM已成功地用于在随机临床试验,以提高放射治疗的患者的膀胱和喉癌功效37,38,以及用于预防光化性角化病和非黑色素瘤皮肤癌的39。后者的作用与CD68 +炎性巨噬细胞40减少的肿瘤浸润有关,这与我们在治疗环境中的观察一致。在苯并(a)re诱导的肺致癌作用的临床前模型中,口服(但不经鼻)NAM的给药也显示了抗癌作用41。因此,可能NAM施加的相对广泛的肿瘤抑制作用,与其他维生素例如吡哆醇和骨化三醇,它未能使oncoprevention在观察或介入临床研究对比42,43,44。值得注意的是,目前正在研究在NAM存在下扩增的单倍体或错配的相关供体NK细胞,用于治疗难治性/复发性多发性骨髓瘤和非霍奇金淋巴瘤(NCT03019666),从而证实了NAM作为临床免疫刺激剂的潜力不断提高。
至于作用方式,看来NAM可以通过直接(T细胞活化)和间接(癌细胞分泌I型IFN和CCL2)机制重建T细胞依赖性免疫监视来充当治疗剂。然而,仍需要阐明NAM的这种有益作用的精确分子级联。羟基羧酸受体2(HCAR2)是烟酸的G蛋白偶联受体,据报道可通过抑制癌细胞存活来抑制小鼠乳腺肿瘤的发生45。但是,HCAR2对NAM的亲和力比对烟酸低46倍,尽管不能排除肠道微生物将NAM转化为烟酸的一定程度47,肝代谢通过形成NAM 47有效地从循环中除去烟酸。此外,暴露于高度超生理学NAM浓度高达80 mM的小鼠BC细胞并未发生明显的细胞死亡,排除了NAM介导模型中治疗作用的机制的细胞毒性(进一步证实,NAM无法减慢肿瘤的生长) T细胞耗竭后体内)。
这些观察结果不仅使人怀疑HCAR2在NAM对乳腺肿瘤的有益作用中的实际意义,而且还反对Sirtuin 1(SIRT1)抑制作用的参与,后者与暴露于高剂量的人BC细胞的死亡有关。剂量NAM 48。值得注意的是,低浓度NAM据报道,激活大量设置(而不是抑制)SIRT1 49,和SIRT1职能似乎只需要在各种设置强健的免疫反应50,51。需要额外的工作来评估SIRT1对管腔B BC免疫监视的影响。
最后,NAM还可以充当免疫抑制NAD +消耗酶的抑制剂,这些酶产生NAM作为催化产物,例如CD38(参考文献52)或聚(ADP-核糖)聚合酶1(PARP1)。有趣的是,PARP1最近已显示,以限制I型IFN分泌由癌细胞与DNA损伤反应的缺陷53,54,我们的发现表明,NAM不仅有利于体外维持的TSA细胞分泌I型IFN,而且(1)在浸润免疫活性宿主中建立的TSA肿瘤的免疫细胞中引起I型IFN信号转导,并且(2)起到预防作用(至少部分取决于)I型IFN反应的治疗效果。也就是说,PARP1抑制是否是NAM对乳腺肿瘤有益作用的基础尚待实验验证。
不管这些迄今未经检验的可能性如何,NAM补充剂都是预防和治疗HR + BC 的安全有效选择。迫切需要进行前瞻性,随机化的临床试验来阐明NAM的预防作用。
方法
细胞系
小鼠乳腺腺癌TSA细胞(#SCC177),小鼠乳腺AT3细胞(#SCC178)和小鼠纤维肉瘤MCA205细胞(#SCC173)获自Millipore Sigma。将所有细胞系在含有10%胎牛血清(FBS),100 U mL -1青霉素钠和100μgmL -1的适当培养基中于37°C于5%CO 2下培养硫酸链霉素(均包含在Thermo Fisher的#15070063中)。在Dulbecco's Modify of Eagle's Medium(DMEM,#11960044 from Thermo Fisher),AT3细胞在RPMI 1640培养基(#11875119,Thermo Fisher)中培养MCA205细胞,并在RPMI 1640培养基中按上述方法添加1mM丙酮酸钠( #11360070,Thermo Fisher)和1 mM HEPES缓冲液(#15630106,Thermo Fisher)。常规检查所有细胞系的支原体。基于PCR的LookOut®支原体PCR检测试剂盒(#MP0035,Millipore Sigma)
原代细胞培养
处死后,通过手术回收来自WT或Rag2 -/-小鼠中M / D驱动的肿瘤的细胞,并在补充有100 U mL -1青霉素钠,100 µg mL的DMEM / F12培养基(#10565042,Thermo Fisher)中洗涤-1硫酸链霉素和100 µg mL -1庆大霉素。然后将它们在补充有0.15%A型胶原酶(#10103578001,Millipore Sigma)的洗涤介质中在37°C下解离30分钟(偶尔进行机械分散)。解离后,将细胞在预先涂有0.1%明胶的烧瓶中(4 h,37°C)在添加2%FBS,50 µg mL -1硫酸庆大霉素的DMEM / F12培养基(#15750078,Thermo Fisher)中培养, 10 ng毫升-1胰岛素(#I0516,密理博Sigma)和5 ng mL -1上皮生长因子(EGF; Thermo Fisher的#SRP3196)。
小鼠乳腺类器官(MMGO)
为了进行MMGO处理,在塑料制品上预先涂以PBS,该PBS补充有2.5 mg mL -1牛血清白蛋白(BSA,#700-100P,来自Gemini Bio-Products)。收集乳腺,并去除淋巴结。然后用剪刀切碎乳腺,并在补充有5%FBS,50 µg mL -1硫酸庆大霉素,5 ng mL -1胰岛素,0.04%(w / v)胰蛋白酶-EDTA的DMEM / F12培养基中消化(#15400054,Thermo Fisher)和2 mg mL -1在HulaMixer样品混合器(Life Technologies)中,在37°C和100 rpm下,胶原酶A(#10103586001,Roche)处理1 h。此后,将乳腺剧烈摇动以破坏脂肪细胞,并以520g将细胞沉淀10分钟。在DMEM / F12培养基中进一步洗涤后,细胞沉淀和脂肪层均被回收。将后者机械解离,再次沉淀,然后添加到细胞沉淀中。此后,将细胞重悬于补充有4 U mL -1 DNase I(#DPRF,Worthington Biochemical)的DMEM / F12培养基中5分钟,沉淀并通过差速离心清除。最终收集了乳类器官,并将其包埋在Matrigel®Matrix(#356255,康宁)中进行3D培养。
老鼠
使用6-15周龄的WT或转基因的C57BL / 6和BALB / c雌性小鼠(Mus musculus)。将小鼠维持在标准的特定无病原体(SPF)居住条件下(20±2°C,50±5%湿度,12h-12h暗暗周期,随意进食和饮水)),除非根据研究设计进行了指定。动物实验遵循欧洲实验室动物科学协会联合会(FELASA)指南,符合EU指令63/2010(协议2012_034A),并获得了居斯塔夫·鲁西(Gustave Roussy)机构伦理委员会动物实验的批准(编号2016031417225217),中心de Recherche des Cordeliers(编号2016041518388910)和Weill Cornell医学院(编号2017-0007和2018-0002)。WT C57BL / 6和BALB / c小鼠从Harlan France或Taconic Farms获得,Rag2 - / - Il2rg - / -,Rag2 -/- ,Casp1 -/-,Il21 -/-,Il21r-/-,Il1r1-/-,Nlrp3 -/-,Ifng -/-和Ifnar1 - / -小鼠从The Jackson Lab获得,Il22 -/-和Myd88 -/-小鼠从CNRS UMR 7355(奥尔良,法国)。MMTV-PyMT小鼠从MF教授的Krummel(UCSF,旧金山,CA,USA),获得BECN1 + / -来自B.莱文教授(UT西南医疗中心,达拉斯,TX,USA),小鼠Atg5的FL / FLKRT5-Cre小鼠J. Penninger教授(分子生物学技术研究所,奥地利维也纳),最初来自水岛伸郎教授(东京大学,日本东京),并提供了ERαAF -2 0和ER C451A小鼠F. Lenfant教授(法国图卢兹,INSERM U1048)。在所有实验中,均常规监测小鼠的肿瘤生长,并在肿瘤表面达到200-250 mm2(伦理学终点)时,或在存在明显窘迫迹象(例如,驼背,食欲不振,肿瘤溃疡)的情况下对小鼠实施安乐死。
肿瘤发生
通过手术将50 mg缓释(90天)MPA颗粒(#NP-161,美国创新研究)皮下植入6至9周龄的雌性小鼠中(第0天)。每周一次,通过口服管饲法给小鼠200 µL 5 mg mL -1的 7,12-二甲基苯并[a]蒽(DMBA;#D3254,购自Millipore Sigma)在玉米油(#C8267,Millipore Sigma)中的溶液。植入MPA颗粒后第1、2、3、5、6和7周。
可移植性乳腺癌
对于致癌性测定,从Rag2 - / -或C57BL / 6小鼠(MGT)进化的M / D驱动肿瘤建立的1.0×10 6 AT3、0.1 ×10 6 TSA,0.3×10 6 MCA205细胞或0.5×10 6细胞皮下注射或注射到同系小鼠的乳腺脂肪垫中。
耗尽/中和程序
所有阻断或中和特定免疫细胞群体,细胞因子或细胞因子受体的抗体及其相应的同种型对照均来自BioXCell(西黎巴嫩):CD4(克隆GK1.5,#BE0003-1),CD8α(克隆2.43,#BE0061), NKG2D(克隆HMG2D,#BE0111),NK1.1(克隆PK136,#BE0036),PD-1(克隆RMP1-14,#BE0146),IFNγ(克隆R4-6A2,#BE0054),IFNAR1(克隆MAR1-5A3) ,#BE0241),IL-17A(克隆17F3,#BE0173)。每8天一次腹膜内施用0.2-0.4 mg /小鼠的抗体,如果是抗PD1,则每3天腹膜内施用3次。对于疫苗接种实验,使用特定抗体(BD Biosciences的克隆29,#610066)实现ANXA1中和。
食品和药品
在饮用水中分别以10μgmL -1和0.5%(w / v)的浓度对他莫昔芬(#T5648,Millipore Sigma)和NAM(#N0636,Millipore Sigma)进行管理。对于饥饿实验,小鼠每两周进行一次24小时禁食周期(随意饮水)。补充NR的药丸(3.33 g Kg -1药丸),HSD和HFD以及相应的安慰剂药丸购自SsniffSpezialdiätenGmbH。ip递送盐酸吡rid醇(187 mg Kg -1),骨化三醇(300 µg Kg -1)和亚精胺(50 mg Kg -1)(分别来自Millipore Sigma,目录号#P9755,#C0225000和#S2626)。。每周一次加入100μLPBS中。对于体内实验,为5.17 mg Kgip施用-1 MTX(#M2305000,Millipore Sigma)。在200 µL PBS中随机分组一次。每周更换三次溶液和瓶子。
疫苗接种实验
将细胞系或MMGOs在体外暴露于1μMMTX或20 Gy照射下,孵育24小时以获得约50–60%的垂死细胞,然后在1周前的第4周注射到WT小鼠的乳腺脂肪垫中(休息周)的一周,以及DMBA灌输之后的2天。通过在疫苗接种前后24小时内在乳腺脂肪垫中注射12.5 µg的封闭抗体(或相应的同型对照)来实现ANXA1封闭,并在疫苗中补充250 µg mL -1的相同抗体。
组织学研究
将组织在4%甲醛(#F8775,密理博(Millipore Sigma))中固定过夜,并保存在70%乙醇中,直至被包括在石蜡中。组织处理由Weill Cornell Medicine的电子显微镜和组织学服务进行。使用Tissue-TekVIP®6 AI真空渗透处理器和组织嵌入控制台(Sakura)对固定的组织进行处理和包埋。加工过程由多个乙醇脱水步骤组成,每个步骤1.5小时:70%,85%,95%,95%,100%和100%。随后进行两次HistoChoice®Clearing Agent(H2779-1L,密理博(Millipore Sigma))交换和三次石蜡交换(每次2小时)。所有步骤均在真空和压力下进行。石蜡步骤在60°C下进行,所有其他步骤在室温(RT)下进行。块被切成7微米厚,收集到带正电的载玻片上,并用苏木精和曙红染色试剂盒(#H-3502,Vector Laboratories)染色。将M / D驱动的肿瘤的组织学与HR的存档图像进行比较+从康乃尔大学威尔医学院BC组织(由赛霍达博士友好提供)。
免疫荧光显微镜—M / D驱动的肿瘤
通过在二甲苯(#214736,Millipore Sigma)中进行3次孵育(每次5分钟),然后连续进行100次(每次2x,3分钟)孵育,将用于组织学研究的具有M / D驱动肿瘤的玻片脱蜡并重新水合。 90、80和70%的乙醇。在室温下,用MaxBlock™自发荧光还原试剂(#MB-L,MaxVision Biosciences Inc.)封闭自发荧光10分钟,然后在60%乙醇中洗涤并在去离子水中孵育(每次3次,每次5分钟)。通过在1X柠檬酸盐缓冲液(pH 6,#C9999,来自Millipore Sigma)中将切片煮沸50分钟,然后用PBS漂洗(4x),并用TBS-3中的3%BSA封闭非特异性结合位点来实现抗原修复。在室温下吐温30分钟。然后将玻片与以下一抗在4°C孵育过夜:抗ESR1-AlexaFluor488(1:20,来自Santa Cruz Biotechnology的#sc-8005)和抗VIM(来自GeneTex的1:250,#GTX100619)。接下来,将载玻片在TBS-Tween中漂洗3次,与AlexaFluor594偶联的山羊抗兔抗体(1:500;来自Abcam的#ab150084)在室温下孵育30-60分钟,再在TBS-Tween中漂洗3次,在去离子水中1x,然后与检测后调节剂(#MB-L的一部分,MaxVision Biosciences Inc.)在室温下孵育5分钟。最后,将玻片在5 µg mL中孵育-1 Hoechst 33258(#H3569,Thermo Fisher)在室温下放置10分钟,与ProLong™金刚石抗褪色剂(#P36961,Thermo Fisher)一起安装,并在由NIS-Elements AR v操作的Eclipse TiE电动数字荧光显微镜上成像。 4.11(Nikon)。
免疫荧光显微镜—TSA肿瘤
将新鲜切除的TSA肿瘤在包埋石蜡之前,先用锌固定剂(#552658,BD Biosciences)固定。脱蜡和脱水后,将玻片在去克隆培养基(#RD913M,Zytomed)中煮沸,用过氧化物块(#ZUC019-008,Zytomed),正常山羊血清(#S-1000-20,Vector Laboratories)处理并用CD8A特异的一抗(1:2000,#14-0808-80,购自Thermo Fisher)和ImmPRESSTM HRP抗鼠IgG二级抗体(可使用,#MP-7444-15,来自Vector Laboratories)。用Opal650 OPAL试剂(1:300,#NEL811001KT的一部分,Akoya Biosciences)进行检测。用4',6-diamidino-2-phenylindole(DAPI,2滴mL -1进行核染色后(来自Akoya Biosciences的#NEL811001KT的一部分)安装在载有Vectra Polaris v.1(Perkin Elmer)的Vectra Polaris™自动定量病理成像系统上的载玻片上并进行评估。整个载玻片第一扫描,随后采集覆盖几乎整个肿瘤表面与用通知v分析Phenochart诉1.0.8,多个感兴趣的区域。2.4.6(伊势Biosciences公司)55,56。
细胞死亡
在用0.5 µg mL -1碘化丙锭(PI,Millipore Sigma的#P4170)染色后,在MACSQuant分析仪v.2.11(Miltenyi)上运行的MACSQuant分析仪上通过流式细胞术对细胞死亡进行定量分析57。补充图8中例示了选通过程 。
逆转录PCR
小鼠Ccl2和Ifnb1水平相对于Rpl13水平通过基于Bio-Rad的商业引物集的2步RT-PCR进行定量(Ccl2,独特测定ID qMmuCED0003785; Ifnb1,独特测定ID qMmuCED0002606; Rpl13a,独特测定ID qMmuCED0040629), SuperScript™VILO™预混液(Thermo Fisher的#11755500)和iTaq通用SYBR Green Supermix(Bio-Rad的#1725121)。或者,根据商业引物和探针组,通过1步RT-PCR,相对于Rpl13水平定量小鼠Gzmb,Ifnb1,Ifng和Prf1水平(Gzmb,#Mm00442837_m1; Ifnb1,#Mm00439552_s1; Ifng,#Mm01168134; Pfr1,#Mm00812512_m1;Rpl13,#Mm02526700_g1)和TaqMan™快速病毒1-Step预混液(#4444434),均来自Thermo Fisher。根据引物制造商提供的热规程,在由嵌入式软件v。2.3操作的7500 RT-PCR系统(Applied Biosystems)上进行扩增。RT-PCR数据是根据归一化ΔC 吨或ΔΔC 吨方法。
CRISPR / Cas9
使用TransIT,用对照商业CRISPR-cas9质粒(#CRISPR06-1EA,来自Millipore Sigma)或特异于Atg7的CRISPR-cas9质粒(Millipore Sigma基于#CRISPR06-1EA定制)转染TSA细胞。-CRISPR®试剂(#T1706,Sigma Aldrich)。将GFP +克隆在由FACSDiva™v。6.1.3(来自BD Biosciences)操作的FACSAria II Sorter上分选到96孔板中,然后进行克隆选择和通过免疫印迹确认ATG7的状态。
ShRNA转染
按照生产商的说明,使用FuGen®HD转染试剂(#E2311,Promega),用编码Atg7特异性shRNA的市售质粒(#TG504956,Origene Technologies)稳定转染AT3细胞。通过免疫印迹确认ATG7状态。
NAM量化
NAM的目标LC / MS分析在Q Exactive™Orbitrap质谱仪(Thermo Fisher)上进行,该质谱仪与Xcalibur v。4.0.27.19(Thermo Fisher)操作的Vanquish™HPLC系统连接。使用SeQuant®ZIC®-HILIC色谱柱(内径2.1 mm×150 mm,Merck)进行代谢物分离。流速设定为150μL/ min。缓冲液由100%乙腈(用于流动剂A)和0.1%NH 4 OH / 20 mM CH 3 COONH 4的水溶液组成(对于流动剂B)组成。梯度在20分钟内从85%升至30%A,然后用30%A和在85%A浓度下重新平衡。NAM是在正离子模式下根据5 ppm内的精确质量和标准保留时间确定的。使用基于NAM的标准曲线进行绝对定量。
免疫印迹
为了在体内检测自噬生物标志物,将组织速冻,然后在细胞裂解之前进行机械破坏。对于ATG7检测,将细胞系进行标准裂解程序。在这两种情况下,在NuPAGE®Novex®Bis-Tris 4-12%预制凝胶(Invitrogen)上分离50 µg蛋白,然后电转移到聚二氟乙烯(PVDF)膜(Millipore Sigma)上。将膜用添加有5%脱脂奶粉的0.05%Tween 20(v / v在TBS中)封闭1小时,并与MAP1LC3B特异性一抗(Cell Signaling Technology的1:1000,#2775),SQSTM1孵育过夜(1:1000,#5114来自Cell Signaling Technology),ATG7(1:1000,克隆D12B11,#8558来自Cell Signaling Technology;或1:3000,克隆ATG7-13,Millipore Sigma#SAB4200304)或ACTB(1 :1000,来自Cell Signaling Technology的克隆13E5,#4970;或1:2000,在4°C下克隆8H10D10,来自Cell Signaling Technology的#3700)。用缀有辣根过氧化物酶(HRP)的抗小鼠(#NA931,来自GE Healthcare Life Sciences,1:5000)或抗兔(#NA934,来自GE Healthcare Life Sciences,1:5000)二级抗体和用Pierce™ECL Plus化学发光底物(#32132,Thermo Fisher)在由cSeries Capture v。1.6.8.1110(Azure Biosystems)操作的C600 Gel Doc&Western Imaging System上显示。
流式细胞仪—肿瘤和乳腺加工
回收由M / D驱动的肿瘤和乳腺,用剪刀剪开并在补充了26.67 µg mL -1Liberase™(#5401119001,Millipore Sigma)和0.0167 MU mL -1 DNase I的RPMI培养基中于37°C消化30分钟。 C。然后加入补充有10%FBS的RPMI培养基以停止酶的活性,并在带有注射器柱塞背面的100 µm细胞过滤器上压碎肿瘤。洗涤后,将细胞以300 g沉淀5分钟,然后重悬于补充有10%FBS的10 mL RPMI培养基中。
流式细胞仪-脾和淋巴结处理
收集脾脏和腹股沟淋巴结并将其压碎在两个显微镜载玻片之间。将细胞重悬于RPMI培养基中,通过70 µM SmartStrainers(#130-098-462,Miltenyi)过滤,并于300 g沉淀5分钟。最后将脾细胞和淋巴结细胞重悬于分别添加10%FBS的2 mL和500μLRPMI中。
流式细胞仪—体外T和NK细胞表型
PBMC是由Ficoll®Paque PLUS(#17-1440-02,GE Healthcare Life Sciences)从健康捐献者的10 mL血液等分试样中分离得到的(遵循布拉格Motol大学医院的道德准则,并收集知情同意书)梯度离心。然后将PBMC在50存在纳克毫升培养过夜-1佛波醇12-肉豆蔻酸酯13-乙酸酯(PMA,来自Millipore西格玛#P8139)加1微克毫升-1单独使用离子霉素(#I3909,Millipore Sigma)或与NAM结合,然后与布雷菲德菌素A(1:1000,#420601,得自BioLegend)孵育3小时。然后将细胞在PBS中洗涤,用抗CD45-PE(1:15,克隆HI30,来自Thermo Fisher的#MHCD4517)抗CD3-AlexaFluor700(1:20,克隆MEM-57,#A7-202-T100)染色抗CD8-HV500(1:20,RPA-T8克隆,来自BD Biosciences的#560775)单克隆抗体,或抗CD45-V500(1:15,克隆HI30,来自BD Biosciences的#560777),抗-CD3-AlexaFluor700(1:20,来自EXBIO的克隆OKT3,#A7-631-T100)和抗CD56-ECD(1:15,来自Beckman Coulter的克隆N901,#B49214)单克隆抗体,然后在eBioscience™中固定固定/通透缓冲液(Thermo Fisher的#88-8824-00的一部分),并进一步通过eBioscience™透化缓冲液(#88-8824-00的一部分,Thermo Fisher)和抗IFNγ-PE-Cy7(1:100,来自Thermo Fisher的克隆4S.B3,#25-7319-82)和抗GZMB-BV421(1:25,克隆GB11,#563389)进行细胞内染色来自BD Biosciences)单克隆抗体。在由FACSDiva TM v.6.2(BD Biosciences)操作的LSRFortessa TM流式细胞仪上进行流式细胞术,并用FlowJo v 9.5.3(TreeStar,Inc。)分析数据。选通过程以补充图为例。 8。
流式细胞仪—免疫浸润液的表型
为了进行免疫细胞表型分析,对100 µL脾脏,淋巴结,肿瘤和乳腺悬液进行以下操作之一,然后在FACSDiva™v。6.1.3操作的LSR II流式细胞仪上采集染色的样品(BD Biosciences ),并使用FlowJo v。X.6.2进行分析。
为了评估T淋巴细胞产生的细胞因子,在含有20 ng mL -1 PMA和1 µg mL -1的无血清CTL-Test™PLUS培养基(#CTLT-010,ImmunoSpot)中对细胞进行(重新)刺激5小时。离子霉素与BD GolgiPlug™(1:100,#555029,来自BD Biosciences)。之后,将T细胞用LIVE / DEAD™可固定黄色染料(1:500,来自Thermo Fisher的#L34959)染色。Fc受体被抗小鼠CD16 / CD32试剂Mouse BD Fc Block™(1:200,克隆2.4G2,#553141,来自BD Biosciences)阻断。用以下荧光染料偶联的抗体染色表面标记:抗CD3-BV421(1:100,克隆145-2C11,来自BD Biosciences的#562600),抗CD8-FITC(1:400,克隆53-6.7) (BD Biosciences的#553030)和抗CD4-PerCP-Cy5.5(1; 400,RM4-5的克隆,Thermo Fisher的#45-0042-82)。然后将细胞固定并在Cytofix / Cytoperm™缓冲液(#554714,BD Biosciences)中透化,并用抗IFN-γ-APC(1:100,克隆XMG1.2,#554413来自BD Biosciences)进行细胞内细胞因子染色。 ,抗TNFα-APC-Cy7(1:200,克隆MP6-XT22,#506307,来自BioLegend)和抗IL-2-PE(1:300,克隆JES6-%H4,#554428,来自BD Biosciences)。选通过程以补充图为例。 8。
为了测量αβT淋巴细胞的数量及其激活/耗尽状态,将细胞用LIVE / DEAD™Fixable Yellow染料染色,并如上所述封闭Fc受体。然后,使用以下荧光抗体实现细胞表面染色:抗CD3-APC(1:200,克隆17A2,Thermo Fisher的#17-0032-82),抗CD8-PE(1:400,克隆53) -6.7,来自BD Biosciences的#553032),抗CD4-PerCP-Cy5.5(1:400,克隆RM4-5,来自Thermo Fisher的#45-0042-82),抗CD25 PE-Cy7(1:100 ,克隆PC61.5,#25-0251-82(来自Thermo Fisher)和抗PD-1-APC / Fire750(1:100,克隆29 F.1A12,#135239来自BioLegend)。然后将细胞固定并在1X Foxp3转录因子染色缓冲液(#A25866A的一部分,购自Thermo Fisher)中透化。最后,用抗FOXP3-FITC(1:50,克隆FJK-16s,#11-5773-82(来自Thermo Fisher)和抗Ki67-AlexaFluor700(1:100,克隆B56,#561277来自BD Biosciences)。选通过程以补充图为例。 8。
或者,将细胞用LIVE / DEAD™可固定黄色染料染色,并如上所述将Fc受体封闭,然后在用抗CD3-FITC(1:800,克隆17A2,#11-进行表面染色)后在Cytofix / Cytoperm™缓冲液中固定0032-82(来自Thermo Fisher),抗NK1.1-PerCP-Cy5.5(1:100,克隆PK136,#551114来自BD Biosciences),抗B220-V450(1:100,克隆RA3-6B2,# (BD Biosciences的560473)和抗CD19-APC-Vio770(1:50,克隆REA749,Miltenyi的#130-111-886)。补充图8中例示了选通过程 。
RNA序列
回收感兴趣的组织(包括肿瘤),在RNAlater RNA稳定试剂(#R0901,Millipore Sigma)中稳定化,并按照制造商的说明使用RNeasy Mini试剂盒(#74104,Qiagen)提取RNA。测序,数据质量,读取分区(例如,可能的核糖体污染)由GenoSplice技术(www.genosplice.com)使用Mouse Gene v。1.0 ST Array进行,数据如图1或FastQC v.0.11.2 所示。 ,Picard-Tools 1.119版,Samtools 1.0版和RSeQC 2.3.9版,以获取图 6和补充图 3中显示的数据。
单细胞RNAseq-细胞分离
从每组三只小鼠中回收TSA肿瘤,并按照制造商的说明使用Tumor Dissociation Kit,小鼠(#130-096-730,Miltenyi)和gentleMACS™Octo Dissociator(Miltenyi)进行解离。合并后,按照制造商的说明,使用CD45 MicroBeads(#130-052-301,Miltenyi)和MACS分离器(Miltenyi)对样品进行CD45 +细胞的磁分离。通过在Cellometer AutoT4细胞计数器(Nexcelom Bioscience)上用PBS中的0.05%锥虫蓝(#T6146,Millipore Sigma)染色细胞等分试样来测试活力,然后将CD45 +细胞重悬于补充有0.1%BSA的PBS中。
单细胞RNAseq-样品制备和处理
如下在Weill Cornell Medicine的Epigenomics核心进行单细胞3'RNA-seq v.2的文库制备,原始数据的测序和后处理。根据10X Genomics规范(单细胞3'试剂盒v.2用户指南PN-120236,10x Genomics)制备单细胞RNAseq库。两个独立的细胞悬液(〜60%存活),浓度约为900个细胞µL -1将其加载到10X Genomics Chromium平台上以生成条码化的单细胞GEM,每个样品靶向3000个单细胞。在带有96深孔反应模块(Bio-Rad)的C1000触摸式热循环仪中进行GEM反转录(53°C 45分钟,85°C 5分钟;保持在4°C)。逆转录后,GEM断裂,并用DynaBeads MyOne Silane Beads(#37002D,Thermo Fisher)清除单链cDNA。使用带有96深孔反应模块的C1000 Touch热循环仪,将cDNA扩增12个循环(98°C 3分钟; 98°C 15 s,67°C 20 s,72°C 1分钟)。使用Bioanalyzer 2100(Agilent)评估cDNA的质量,获得约1693bp的产物。该cDNA已酶切,末端修复,A尾,用SPRIselect珠子(#B23317,Beckman Coulter)进行双面大小选择,并连接到试剂盒中提供的衔接子。使用试剂盒中提供的索引,通过13个PCR扩增循环为每个文库引入唯一的样品索引(98°C持续45 s; 98°C持续20 s,54°C持续30 s,72°C持续20 s) s×14个周期; 72°C持续1分钟;保持在4°C)。对标引的文库进行第二次双面大小选择,然后使用Qubit 4荧光计(Thermo Fisher)对文库进行定量。在Bioanalyzer 2100上评估质量,获得的平均文库大小为455 bp。最终将文库稀释至2 nM,并在高输出模式下以10 pM在对端读取流动池上以高输出模式聚集在HiSeq2500系统(Illumina)上,并在R1(10X条码和UMI)上测序26个循环,随后是8个I7索引(样本索引)循环,以及98个基于R2(转录本)的碱基,每个样本的读取范围约为100M。测序图像的主要处理是使用Illumina的实时分析(RTA)软件3.4.4版完成的。
重现性和数据管理
除非另有说明,否则所有实验都是在两个独立的实例中进行的,结果相似。在每个单独的实验中,样品仅测量一次。转录组学和scRNAseq结果来自涉及指定数目的小鼠的单个实验。除非另有说明,否则Excel 2013(Microsoft)和Prism v。8.4(GraphPad)用于数据管理,绘图和统计分析。使用Illustrator 2020(Adobe)和Photoshop 2020(Adobe)进行图形准备。
统计分析-肿瘤发生率和增长
常规通过椭圆面积公式(π × A × B)/ 4 评估肿瘤表面,其中A和B分别是最大和最小病变直径。生长曲线的统计显着性通过TumGrowth软件1 58版或经过行(时间)和列(处理)因子校正的双向ANOVA进行评估。Kaplan Meyer曲线(TFS,OS和TTD)的统计显着性通过双面对数秩(Cox比例风险模型)或单向ANOVA加Fisher LSD检验进行评估。
统计分析—体外,成像和流式细胞仪检测
RT-PCR,免疫荧光显微镜和流式细胞术(包括细胞死亡)数据的统计显着性通过一种方差分析(ANOVA + Fisher LSD检验)进行评估,以进行涉及两组以上样本的比较,或者使用未配对的双面学生t检验进行比较仅涉及两组样本。
统计分析—大量RNAseq
对于图1中显示的数据 ,我们使用了Affymetrix © Mouse Gene v。1.0 ST Array。使用Affymetrix © TAC v.4.1.1对数据进行标准化。在R计算环境v。3.4中进行了分析。具体地,通过使用limma v.3.32.10(参考文献59),以| logFC |作为阈值,根据基因的差异表达选择基因。> 2,且p值<0.05。使用DAVID功能注释工具6.8版(参考资料60)对差异表达的基因进行了GO富集分析。用于将小鼠RNAseq数据与人BC中的基因表达进行比较(补充图 1中显示的数据)),我们利用了TCGA数据库中的微阵列数据。在R计算环境3.6.0版中,我们重新标准化了鼠标数据(居中和缩小),以获得与人类数据相似的分布。然后,我们施加genefu诉功能subtype.cluster。2.16.0(参考文献61基于以前出版的BC分类算法)62,63。包装基因的其他分类方法产生了相似的结果。基于欧氏距离和ward.D2聚类方法,使用ComplexHeatmap 2.0.0版完成了带有分层聚类分析的热图。ENSEMBL基因100用于鉴定人与小鼠之间的直系同源基因。
对于图 6和补充图 3中显示的数据,通过GenoSplice技术(www.genosplice.com)进行了分析。读取使用STAR V一样映射。2.4.0(参考文献64上MM10小鼠基因组组件),其次是基因表达分析65。简而言之,对于Mouse FAST DB v。2016_1注释中存在的每个基因,对在组成性区域(不容易发生可变剪接)上排列的读数进行计数。根据这些计数,使用DESeq2 v。1.28.1(参考资料66)进行归一化和差异基因表达。)在R计算环境(v.3.2.5)中。仅进一步分析在至少一种实验条件下表达的基因。为此,基于基因间区域,如果基因的rpkm值大于背景rpkm值的93%,则认为基因已表达。结果被认为是统计上显著p值≤0.05,倍数变化≥1.5。基于给定模块内基因的共表达来定义基因模块。给定模块内的所有基因都必须相互关联。需要最小的Pearson相关系数为0.7(即,仅正相关),并且至少使用50个基因来定义模块。基于欧氏距离和Ward凝聚方法,使用R的dist和hclust函数获得聚类和热图。使用DAVID功能注释工具6.8版对丰富的GO项,KEGG途径和REACTOME途径进行了分析。如果倍数富集≥2.0,未校正p,则认为GO术语和途径已富集值≤0.05,且通路/术语中受调控基因的最小数目≥2.0。对所有调节基因,仅上调基因和下调基因进行了分析。对这些分析进行了综合,以提供单一结果列表。使用通路分析(IPA®)v.52912811对AT3和M / D驱动的肿瘤上常见上调基因的富集GO通路进行了分析。
统计分析-单细胞RNASeq
使用10X Genomics Cell Ranger单细胞软件套件v2.1.0进行样品多路分离,比对(基于mm10小鼠基因组装配),过滤,UMI计数,单细胞3'端基因计数和质量控制,使用制造商参数。使用Seurat 2.3.4版(参考67)进行无监督的细胞聚类)在R计算环境v.3.5.3中。分析中排除了具有<1000个基因或<3000个UMI或线粒体基因的> 10%以及在<3个细胞中检测到的基因的细胞。使用Seurat NormalizeData函数,以10,000的比例因子和对数转换,按照全局缩放归一化方法对基因表达原始计数进行归一化。选择了前2775个高度可变的基因,然后进行主成分分析(PCA)。排名前35位的电脑上和谐V一样继续使用。0.1.0(参考文献68),并消除两个样本之间混杂因素的影响。前35个和声结果用于生成二维t分布随机邻居嵌入(Seurat中的RunTSNE,困惑度= 30)和共享的最近邻居(Seurat中的FindClusters,k.param = 30,分辨率= 0.6)进行无监督的单元聚类)。通过Seurat中的FindAllMarkers函数生成了一系列保守的细胞类型特异性基因。使用用户定义的基因来鉴定细胞类型,并通过SingleR v。0.2.2确认(参考资料69)。使用ggpubr v.0.2和ggplot2 v.3.1.1生成基因集富集分析和条形图。对差异基因表达和富集分析的统计评估基于MAST模型70和快速基因集富集分析(FGSEA)分别为 71。通过双向Wilcoxon检验对单个基因进行统计学显着性分析。
|
|